INTRODUZIONE
L’infiammazione cronica di basso grado rappresenta oggi uno dei principali meccanismi biologici che collegano obesità, diabete tipo 2 e malattie cardiovascolari [1,2]. Negli ultimi anni, farmaci come semaglutide e tirzepatide — inizialmente sviluppati per il controllo glicemico e il dimagrimento — hanno mostrato effetti che sembrano andare oltre la sola perdita di peso, includendo una possibile modulazione dei processi infiammatori sistemici [4–7]. Comprendere se questi farmaci influenzino direttamente l’infiammazione cronica di basso grado è quindi cruciale per interpretarne il reale impatto sulle malattie croniche e degenerative.
A esempio, abbiamo già discusso gli effetti extra-ponderali dei GLP-1RA nell’articolo sul rischio di NAION, in quello sulla riduzine dell’infiammazione del tessuto adiposo , e in quello sull’infiammazione a livello cardiaco.
Semaglutide e tirzepatide riducono l’infiammazione cronica di basso grado nel contesto metabolico. Le evidenze suggeriscono che gran parte dell’effetto sia mediata dalla riduzione della massa grassa viscerale, con possibili contributi farmacologici diretti ancora da chiarire. La modulazione dell’infiammazione potrebbe rappresentare uno dei meccanismi centrali attraverso cui questi farmaci migliorano il rischio cardiometabolico globale.
Cos’è l’infiammazione cronica di basso grado
L’infiammazione cronica di basso grado (low-grade inflammation, LGI) è caratterizzata da una persistente attivazione del sistema immunitario innato, con aumento di mediatori come TNF-α, IL-6 e proteina C-reattiva (PCR) [1].
Diversamente dall’infiammazione acuta, non produce sintomi evidenti ma contribuisce nel tempo alla progressione di obesità, diabete tipo 2, malattia cardiovascolare e MASH (Metabolic dysfunction–Associated SteatoHepatitis; fase avanzata della steatosi epatica, cioè del fegato infiltrato di grasso) [1,2].
L’infiammazione cronica di basso grado è fortemente influenzata dalla quantità di tessuto adiposo viscerale.
Il tessuto adiposo viscerale, infatti, svolge un ruolo centrale: in condizioni di obesità assume caratteristiche immunometaboliche, con infiltrazione macrofagica e polarizzazione pro-infiammatoria (M1), favorendo la resistenza insulinica [3].
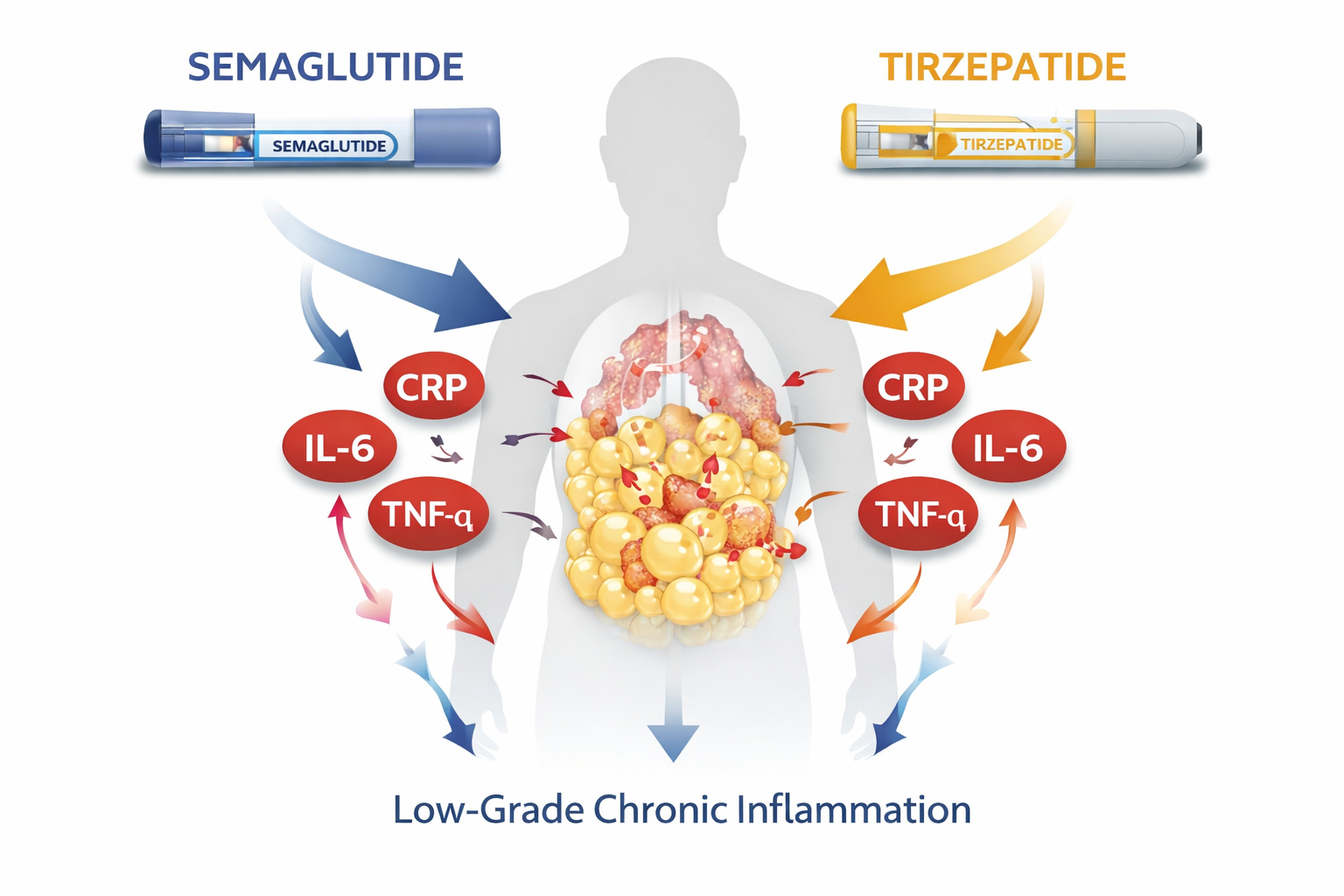
Come il GLP-1 influenza i processi infiammatori
Il recettore GLP-1 è espresso non solo nelle cellule β pancreatiche ma anche in cellule endoteliali, macrofagi e sistema nervoso centrale [4].
In particolare, i dati sperimentali suggeriscono che l’attivazione del GLP-1R possa:
inibire il pathway NF-κB
ridurre lo stress ossidativo
attenuare la produzione di citochine pro-infiammatorie [4,8].
Questi effetti hanno portato a ipotizzare una vera azione immunometabolica dei GLP-1RA oltre al semplice controllo glicemico.
Semaglutide: evidenze cliniche sugli effetti anti-infiammatori
Nei principali trial clinici, semaglutide ha mostrato riduzione significativa dei marker infiammatori, inclusa la proteina C-reattiva [6,9].
Nel trial STEP-1, semaglutide 2.4 mg ha determinato:
marcata perdita ponderale
miglioramento dei parametri cardiometabolici
riduzione dei biomarcatori infiammatori [6].
Tuttavia, la distinzione tra effetto anti-infiammatorio diretto e riduzione secondaria alla perdita di massa grassa non era un endpoint primario dello studio.
Tirzepatide e il doppio agonismo GIP/GLP-1
Tirzepatide, agonista duale GIP/GLP-1, ha mostrato superiorità nella riduzione ponderale rispetto a semaglutide 1 mg nel trial SURPASS-2 [7], con perdita di peso fino al 22,5% nel programma SURMOUNT-1 [10].
Peraltro, studi preclinici indicano che il recettore GIP è espresso anche su cellule immunitarie, suggerendo un possibile ruolo aggiuntivo nella modulazione della risposta infiammatoria [11]. Tuttavia, le evidenze cliniche di un effetto immunomodulante diretto restano indirette.
Effetti diretti o mediati dalla perdita di peso?
La riduzione del tessuto adiposo viscerale è di per sé un potente driver della diminuzione dell’infiammazione sistemica [3].
Molte analisi suggeriscono che una quota sostanziale della riduzione della PCR osservata nei trial sia mediata dal dimagrimento [6]. Di conseguenza, rimane quindi aperta la domanda se i GLP-1RA siano farmaci anti-infiammatori diretti o se agiscano prevalentemente attraverso la perdita di peso.
Probabilmente entrambe le componenti contribuiscono, ma il loro peso relativo non è ancora chiaramente definito [4].
Implicazioni cardiovascolari e metaboliche
Nel trial SUSTAIN-6, semaglutide ha ridotto significativamente gli eventi cardiovascolari maggiori (MACE) [5]. Risultati analoghi sono stati osservati con altri GLP-1RA [12].
Infatti, tali benefici non sono completamente spiegabili dal solo controllo glicemico, è plausibile che la riduzione dell’infiammazione vascolare e dello stress ossidativo contribuisca al beneficio cardiovascolare globale [4,12].
Diabete tipo 2, β-cellula e neuroinfiammazione
L’infiammazione cronica contribuisce alla progressiva disfunzione β-cellulare nel diabete tipo 2 [2]. I GLP-1RA migliorano funzione β-cellulare e sensibilità insulinica [13], anche se non esistono prove definitive di un effetto strutturalmente disease-modifying indipendente dal controllo metabolico.
Dati preclinici suggeriscono inoltre potenziali effetti sulla neuroinfiammazione e sul metabolismo cerebrale [14], ma le evidenze cliniche nell’uomo restano preliminari.
Limiti delle evidenze disponibili
Le conoscenze attuali presentano alcuni limiti:
predominanza di endpoint surrogate
difficoltà nel separare effetto farmacologico diretto e perdita di peso
mancanza di dati istologici umani
follow-up limitato per outcome strutturali.
Conclusioni
In sintesi, semaglutide e tirzepatide rappresentano strumenti terapeutici capaci di ridurre significativamente l’infiammazione cronica di basso grado nel paziente con obesità e dismetabolismo. L’effetto sembra essere in larga parte conseguenza della riduzione della massa adiposa viscerale, ma la possibilità di un’azione immunometabolica diretta resta un’area di ricerca di grande interesse.
Domande frequenti (FAQ)
Semaglutide riduce direttamente l’infiammazione?
I dati sperimentali suggeriscono possibili effetti diretti, ma negli studi clinici gran parte del beneficio sembra mediata dalla perdita di peso [4,6].
Tirzepatide è più anti-infiammatorio di semaglutide?
Non esistono evidenze cliniche definitive che dimostrino una superiorità immunologica specifica [7,10,11].
La riduzione dell’infiammazione dipende dal dimagrimento?
In larga misura sì, ma sono possibili anche effetti diretti dei farmaci [3,4].
Bibliografia
Hotamisligil GS. Inflammation and metabolic disorders. Nature. 2006;444:860-867. https://doi.org/10.1038/nature05485
Donath MY, Shoelson SE. Type 2 diabetes as an inflammatory disease. Nat Rev Immunol. 2011;11:98-107. https://doi.org/10.1038/nri2925
Xu H, et al. Chronic inflammation in fat plays a crucial role in obesity-related insulin resistance. J Clin Invest. 2003;112:1821-1830. https://doi.org/10.1172/JCI19451
Drucker DJ. Mechanisms of Action and Therapeutic Application of GLP-1. J Clin Invest. 2018;128:27-35. https://doi.org/10.1172/JCI97233
Marso SP, et al. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med. 2016;375:1834-1844. https://doi.org/10.1056/NEJMoa1607141
Wilding JPH, et al. Once-Weekly Semaglutide in Adults with Overweight or Obesity. N Engl J Med. 2021;384:989-1002. https://doi.org/10.1056/NEJMoa2032183
Frías JP, et al. Tirzepatide versus Semaglutide Once Weekly in Patients with Type 2 Diabetes (SURPASS-2). N Engl J Med. 2021;385:503-515. https://doi.org/10.1056/NEJMoa2107519
Lee YS, et al. GLP-1 inhibits adipose tissue macrophage infiltration and inflammation. Endocrinology. 2012;153:1114-1123. https://doi.org/10.1210/en.2011-1567
Rubino DM, et al. Effect of Continued Weekly Subcutaneous Semaglutide vs Placebo on Weight Maintenance. JAMA. 2021;325:1414-1425. https://doi.org/10.1001/jama.2021.3224
Jastreboff AM, et al. Tirzepatide Once Weekly for the Treatment of Obesity (SURMOUNT-1). N Engl J Med. 2022;387:205-216. https://doi.org/10.1056/NEJMoa2206038
Varol C, et al. GIP receptor signaling in immune cells and metabolic inflammation. Diabetes. 2014;63:1178-1188. https://doi.org/10.2337/db13-1202
Gerstein HC, et al. Dulaglutide and Cardiovascular Outcomes (REWIND). Lancet. 2019;394:121-130. https://doi.org/10.1016/S0140-6736(19)31149-3
Nauck MA, Meier JJ. Incretin hormones: their role in health and disease. Diabetes Obes Metab. 2018;20(Suppl 1):5-21. https://doi.org/10.1111/dom.13129
Hölscher C. GLP-1 receptor agonists and neuroprotection. Neuropharmacology. 2018;136:3-12. https://doi.org/10.1016/j.neuropharm.2017.11.026
